Správy zo spoločnosti Zentiva

21. novembra 2025 / Články
Lymfóm z plášťových buniek a prvolíniová liečba
doc. MUDr. Ľuboš Drgoňa, CSc., MHA, FECMM, MUDr. Radoslav Greksák, PhD., MPH, Klinika onkohematológie LFUK a NOÚ Bratislava
Lymfóm z plášťových buniek (MCL) je pomenovaný podľa skutočnosti, že vyrastá z plášťových B-lymfocytov okolia germinálneho centra lymfatickej uzliny (LU). V Západnej Európe predstavuje 5-7 % zo všetkých malígnych lymfómov a vyskytuje sa so stúpajúcou incidenciou 1-2/100 000 obyvateľov ročne. Najčastejší výskyt je medzi 60 a 70 rokom života, s mediánom 65 rokov a pomerom výskytu u mužov k ženám 3:1.
MCL charakterizujú nepriaznivé vlastnosti indolentných aj agresívnych lymfómov, čo znamená že je nevyliečiteľný konvenčnou chemoterapiou, po určitom intervale remisie dochádza k recidíve a na rozdiel od indolentných typov má spravidla agresívnejší priebeh. V čase stanovenia diagnózy podiel pacientov s včasným štádiom I-IIA je len v 5-15 % prípadov, u prevažnej väčšiny sa diagnostikuje pokročilé štádium v 85-90 %. V štádiu IV je veľmi častá extranodálna manifestácia až u 80 %: s infiltráciou kostnej drene, Waldeyerovho okruhu, gastrointestinálneho traktu (aj ako lymfomatózna polypóza), sleziny, heparu, CNS, často s leukemizáciou periférnej krvi. Všeobecne MCL má zo základných skupín B-bunkových lymfómov najhoršiu prognózu.
Prognózu MCL ovplyvňujú aj jeho histologické varianty svojím rozdielnym správaním a citlivosťou na terapiu. Najčastejší spravidla s dobrou schopnosťou reagovať na onkologickú liečbu je klasický konvenčný typ (87,5 %), indolentný priebeh má malobunkový typ (3,6 %), a agresívnym správaním a nedostatočnou odpoveďou na terapiu je charakteristický blastoidný typ (2,6 %). Medzi ostatné varianty patria pleomorfný (5,9 %), zmiešaný napr. klasický s pleomorfným, a MCL pozostávajúci sčasti s klasickým a sčasti s pleomorfným zastúpením vedľa seba. Pri nepriaznivom blastoidnom MCL je OS najkratšie (5-r. 35%; HR, 2.35; P < 0.001) a PFS (29%; HR, 1.58; P = 0.007) oproti non-blastoidnej histológii (OS 5-r. 68%; PFS, 44%), nezávisle od MIPI skóre (medzinárodný prognostický index) pre OS (adjusted HR, 1.91; P < 0,001).
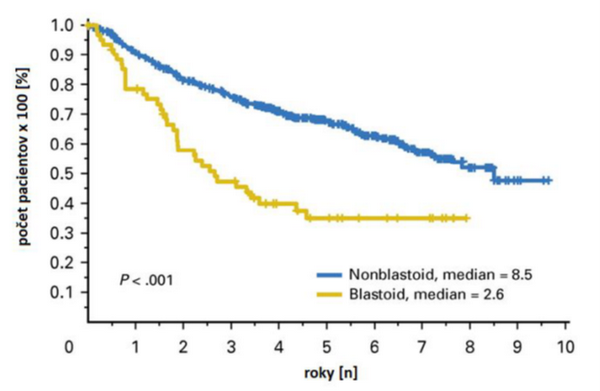
Obrázok 1: Celkové prežívanie (OS) pri blastoidnej a non-blastoidnej forme MCL.
Zdroj: HOSTER, E., ROSENWALD, A., BERGER, F., et al. 2016. Prognostic value of Ki-67 index, cytology, and growth pattern in MCL: results from randomized trials of the European mantle cell lymphoma network. In Journal of Clinical Oncology, ISSN:1527-7755, 2016, roč. 34, č. 12, s. 1386−1394. doi: 10.1200/jco.2015.63.8387
Dostupné na: http://www.ncbi.nlm.nih.gov/pubmed/26926679/
K exaktnému stanoveniu diagnózy MCL je potrebná biopsia celej LU, príp. hruboihlová core-cut biopsia (CCB) paketu LU napr. v retroperitoneu, s doplňujúcim vyšetrením punktátu kostnej drene (KD) spolu s trepanobiopsiou, pri leukemizácii lymfómu vyšetrenie periférnej krvi (PK) prietokovou cytometriou a cytogenetickou analýzou prestavby charakteristických génov. Diagnostický profil povrchových CD (cluster of diferentiation) antigénov je pre MCL typický: CD5+ CD10± CD20+ CD23± CD43+ cyklín-D1+ (negatívny ˂ 5 %), v niektorých prípadoch CD5- alebo CD23+. Cytogenetické vyšetrenie je tiež pre MCL diagnostické s nálezom FISH recipročnej translokácie t(11;14)(q13;q32) s prestavbou a fúziou génov CCND1/IGHV, v menšom počte aj t(14;18)(q32;q21) s prestavbou a fúziou génov IGHV/MALT1 vyskytujúci sa aj u iných typov lymfómov (FL 70-90 %, DLBCL 20-30 %, ostatné 5-10 %). Prestavba a fúzia génov CCND1/IGHV vedie k nadmernej expresii cyklínu-D1, v prípade prestavby a fúzie CCND2 alebo CCND3 k expresii cyklínov-D2 a D3. K diagnostike a prognóze ďalej prispieva nadmerná expresia cyklín dependentnej kinázy 4 (CDK4), mutácia jadrového transkripčného faktora SOX11, vysoká hodnota proliferačného indexu Ki-67, s nepriaznivou prognózou spájané mutácie génov TP53, BCL2, BCL6, mutácia IGHV (16-38 %) a ďalšie mutované gény BTK, BIRC3, MAP3K14, NOTCH1, NSD2, CDKN2A, SMARCA4.
K určeniu štádia lymfómu využívame počítačovú tomografiu (CT), pozitrónovú emisnú tomografiu (PET), vyšetrenie periférnej krvi aj kostnej drene, podľa symptómov endoskopické vyšetrenie, pri blastoidnom variante s Ki-67 ˃ 50 % vyšetrenie likvoru, pri neurologických ťažkostiach MRI CNS a ďalšie. Postupný rast a pribúdanie genetických anomálií a fúzií génov môže viesť k transformácii z pôvodne indolentného priebehu do agresívneho rastu so zmenou morfologického typu na blastoidný s nepriaznivou prognózou.
Na presnejší odhad prognózy MCL sa od roku 2008 používa medzinárodný prognostický index (MIPI) zohľadňujúci vek, počet leukocytov, ECOG stav výkonnosti pacienta a hladinu laktátdehydrogenázy (LDH). Kombinovaný MIPI (MIPI-c) index navyše ako jeden z ďalších parametrov zohľadňuje proliferačnú aktivitu lymfómu Ki-67, ktorej hodnota koreluje s rýchlosťou a agresivitou rastu MCL. Na základe výpočtu MIPI-c boli stanovené 4 rizikové skupiny pacientov s rozdielnym mediánom OS: s nízkym, nízkym stredným, vysokým stredným a vysokým rizikom. Podľa rizika dĺžky prežívania stanoveného pomocou MIPI-c sa následne určuje výber a intenzita onkologickej liečby vrátane indukčného režimu s podaním antracyklínov a rozhodnutie o vysoko-dávkovanej chemoterapii spojenej s autológnou transplantáciou kmeňových buniek krvotvorby.
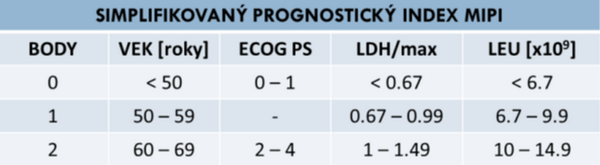
ECOG PS – výkonnostný stav, LDH/max – podiel nameranej a maximálnej fyziologickej hodnoty, LEU – počet leukocytov x109/l
Zdroj: HOSTER, E., ROSENWALD, A., BERGER, F., et al. 2016. Prognostic value of Ki-67 index, cytology, and growth pattern in mantle-cell lymphoma: results from randomized trials of the European mantle cell lymphoma network. In Journal of Clinical Oncology. 2016, roč. 34, č. 12, s. 1386−1394.
V súčasnosti sa MCL považuje za heterogénne ochorenie s viacerými morfologickými a genetickými črtami, k čomu za posledné desaťročie prispelo aj zistenie že podskupina pacientov môže mať indolentný priebeh choroby. Okrem histologického typu má vplyv na prognózu aj histologicky definovaná forma proliferácie a rastu lymfómových buniek, ktorý môže byť nodulárny alebo difúzny. Častejší difúzny rast (80,5 %) je viac spojený s pokročilým štádiom, nedostatočnou odpoveďou na konvenčnú chemoterapiu vrátane antracyklínov, a celkovo zlou prognózou so skráteným OS. Pri nodulárnom raste (19,5 %) sa stretávame s vyšším počtom celkových odpovedí na liečbu (ORR), vrátane kompletných remisií (CR) pri režimoch v 1. línii.
Vzhľadom na uvedené fakty je dôležité pri výbere optimálnej liečby zvažovať postup podľa stupňa rizika, aby sme minimalizovali zbytočnú toxicitu liečby a zároveň maximalizovali dĺžku prežitia a kvalitu života vybraných pacientov s MCL. Korelácia medzi klinickými a patologickými faktormi choroby, vrátane dostupných aktuálnych biomarkerov s prediktívnym významom sú základom rozhodnutia o počiatočnej liečbe v 1. línii, ktoré by sa malo riadiť hodnotením celkového rizika, aby sa odlíšili pacienti, ktorým by stanovená intenzifikovaná terapia prospela, od tých, ktorí by potrebovali menej agresívny režim konvenčnou chemoimunoterapiou alebo novými molekulami.
Nové spôsoby liečby s novými cielenými molekulami (tzv. targeted therapy) sa skúšajú v 1. línii so snahou nahradiť toxickú konvenčnú chemoimunoterapiu s menším profilom nežiaducich účinkov a vyššou efektivitou, ktorá sa odzrkadlí vo vyššom celkovom počte odpovedí (ORR), zlepšení celkového prežívania (OS), a prežívania bez progresie (PFS). Dávajú tiež väčšie šance pre staršiu vekovú skupinu nad 65 rokov v dosiahnutí čo najdlhšieho prežívania pri dobrej kvalite života s redukciou toxicity terapie. Vysokorizikový pacienti s MCL s agresívnym rastom a nepriaznivým cytogenetickým profilom môžu vyžadovať kombinované prístupy, pretože pri tejto skupine samotná chemoimunoterapia nie je dostatočná. Pribúdajúce cielené nové molekuly účinné pri refraktérnych, alebo recidivujúcich prípadoch sa ukazujú ako sľubné aj pre vysokorizikovú skupinu v 1. línii. Je pravdepodobné, že nové prístupy čoskoro nahradia súčasný štandard v liečbe pacientov s MCL v SR.
Výber liečby 1. línie závisí od viacerých faktorov – viď nasledujúca tabuľka.
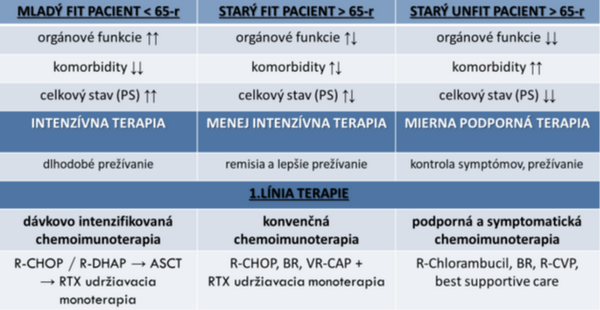
Liečebný postup určuje aj to či je štádium lokalizované (I-IIA, „non-bulky“), alebo pokročilé (IIB-IV, „bulky“, B-symptómy). Termín „bulky“ charakterizuje masu LU rozmerovo väčšiu ako 7 cm, alebo 3 a viac paketov LU nad 3 cm, a medzi B-symptómy patria celkové nešpecifické systémové príznaky: opakované subfebrility až febrility ≥ 38 °C najmä večer, nočné potenie s nutnosťou výmeny prepoteného prádla, a strata na váhe o viac ako 10 % za obdobie posledných 6 mesiacov. Pri lokalizovanom štádiu (5-15 %) môže byť metódou voľby rádioterapia ISRT (involved site radiation therapy) v dávke 30-36 Gy. Dosahuje dlhodobé remisie a predlžuje OS. V 6 roku po RT je OS 71 %, 5-ročné PFS pre pacientov < 60 rokov je 83 % a ≥ 60 rokov 39 % (p=0,04).Podľa iných pozorovaní dochádza po RT k včasným relapsom už do prvého roku po liečbe, a tie sa potom liečia obdobne ako pokročilé štádium. Identicky sa postupuje ak sa po RT nedosiahne kompletná remisia (CR), ale len parciálna remisia (PR), alebo lymfóm progreduje (PRO). Podľa prognostických znakov a lokality je možné zvoliť intenzívnejší prístup tak ako pri lokalizovanom DLBCL (difúzny veľkobunkový lymfóm z B-buniek) v štádiu I-IIA podaním 2-4 cyklov chemoimunoterapie (skrátená indukcia) a následne rádioterapia ako konsolidácia. Ak je pri lokalizovanom MCL veľká nádorová nálož a negatívne prognostické markery, je indikovaná systémová chemoimunoterapia (neskrátená indukcia) tak ako pri pokročilom štádiu a zváženie konsolidačnej RT podľa lokality a očakávaných nežiadúcich účinkov RT. Pokročilé štádium liečime kombináciou cytostatického režimu s monoklonovou protilátkou anti-CD20 RTX (indukcia), vysoko-dávkovanou chemoterapiou (HD-ChT) s ASCT (konsolidácia) a následne udržiavacou imunoterapiou pomocou anti-CD20 RTX. Indukčný režim a indikáciu ASCT určujeme na základe už spomínaných vlastností lymfómu a najmä s prihliadnutím k veku, celkovému stavu a komorbiditám pacienta.
Aktuálne možnosti prvolíniovej liečby v SR popisuje nasledovná tabuľka

Je pravdepodobné, že niektoré z uvedených štandardných postupov budú v blízkej budúcnosti modifikované na základe výsledkov kľúčových klinických štúdií s využitím cielenej liečby (napríklad s inhibítormi Brutónovej tyrozín kinázy).
Literatúra:
HOSTER, E., ROSENWALD, A., BERGER, F., et al. 2016. Prognostic value of Ki-67 index, cytology, and growth pattern in mantle-cell lymphoma: results from randomized trials of the European mantle cell lymphoma network. In Journal of Clinical Oncology. 2016, roč. 34, č. 12, s. 1386−1394.
DREYLING, M., CAMPO, O., HERMINE, M., JERKEMAN, S., LE GOUILL, S., et al. 2017. Newly diagnosed and relapsed mantle cell lymphoma: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. In Annals of Oncology, ISSN:1569-8041, 2017, roč. 28, č. suppl 4, s. iv62–iv71. doi: 10.1093/annonc/mdx223
DREYLING, M. 2014. Mantle cell lymphoma: biology, clinical presentation, and therapeutic approaches. In American Society of Clinical Oncology Educational Book, ISSN:1548-8756, 2014, č. 34, s. 191-198. doi: 10.14694/EdBook_AM.2014.34.191
NABRINSKY, E., DANILOV, A.V., KOLLER, P.B. 2021. High-risk mantle cell lymphoma in the era of novel agents. In Current Hematologic Malignancy Reports, ISSN:1558-822X, 2021, roč. 16, č. 1, s. 8–18. doi: 10.1007/s11899-021-00605-9
RUAN, J., MARTIN, P. 2016. Which patients with mantle cell lymphoma do not need agressive therapy. In Current Hematologic Malignancy Reports, ISSN:1558-822X, 2016, roč. 11, č. 3, s. 234−240. doi: 10.1007/s11899-016-0324-3
ABRISQUETA, P., SCOTT, D.W., SLACK, G.W., STEIDL, C., MOTTOK, A., GASCYONE, R.D., CONNORS, J.M., SEHN, L.H., SAVAGE, K.J., GERRIE, A.S., VILLA, D. 2017. Observation as the initial management strategy in patients with mantle cell lymphoma. In Annals of Oncology, ISSN:0923-7534, 2017, roč. 28, č. 10, s. 2489-2495. doi: 10.1093/annonc/mdx333
MADDOCKS, K. 2018. Update on mantle cell lymphoma. In Blood, ISSN:1528-0020, 2018, roč. 132, č. 16, s. 1647-1656. doi: 10.1182/blood-2018-03-791392
POTT, C., HOSTER, E., BELDJORD, K., et al. 2010. R-CHOP/R-DHAP compared to R-CHOP induction followed by high dose therapy with autologous stem cell transplantation induces higher rates of molecular remission in MCL: results of the MCL younger intergroup trial of the European MCL network. In Blood, ISSN:1528-0020, 2010, roč. 116, č. 21, s. 965. doi: 10.1182/blood.v116.21.965.965
CHEMINANT, M., DREYLING, M., HERMINE, O. 2020. Recent advances in the first-line treatment of mantle cell lymphoma. In Annals of Lymphoma, ISSN:2616-2695, 2020, roč. 4, č. 2, s. 1-8. doi: 10.21037/aol.2019.11.04
Dátum prípravy: november 2025
Kód: 000802686/2025/11