Správy zo spoločnosti Zentiva

8. decembra 2025 / Články
Liečba pacientov s relabujúcim / refraktérnym MCL
MUDr. Radoslav Greksák, PhD., MPH a doc. MUDr. Ľuboš Drgoňa, CSc., MHA, FECMM, Klinika onkohematológie LFUK a NOÚ, Bratislava
Liečba relabujúceho MCL predstavuje výzvu pre pacienta ako aj pre lekára. Napriek zlepšujúcim sa výsledkom liečby MCL v 1. línii dochádza nakoniec skôr či neskôr k relapsom a progresii. Pre tieto prípady nie je zatiaľ stanovená žiadna uniformná štandardná liečba a postupy. K dispozícii máme niekoľko režimov (Tabuľka). Tak ako v 1. línii výber optimálneho režimu pre relabujúcich / refraktérnych (R/R) pacientov s MCL závisí nielen od veku, ale hlavne od celkového stavu výkonnosti a pridružených komorbidít. Treba zohľadniť nielen spektrum vedľajších účinkov nasledujúcej liečby ale aj toleranciu predchádzajúcich podaných režimov a trvaním odpovede na ne. S nástupom cielenej liečby (BTKi) a imunoterapie (napr. CAR T-bunková liečba) a ich zaraďovaním do terapeutických algoritmov sa prirodzene mení pohľad na staršie liečebné režimy ako aj sekvencia jednotlivých liekov v čase.
Možnosti liečby relabovaného / refraktérneho pacienta s MCL podľa veku a stavu v približuje nasledovný obrázok z práce z roku 2020
Zdroj: ref 1.
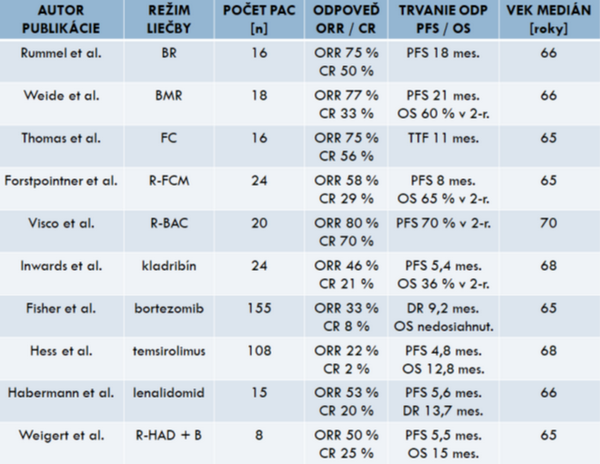
Režimy liečby používané pre starších pacientov ≥ 65 rokov s relabujúcim alebo refraktérnym MCL pred nástupom liečby BTKi a CAR T – lymfocytmi uvádza tabuľka:
BR – bendamustín, rituximab; BMR – bendamustín, mitoxantrón, rituximab; FC – fludarabín, cyklofosfamid; R-FCM – rituximab, fludarabín, cyklofosfamid, mitoxantrón; R-BAC – rituximab, bendamustín, cytarabín; R-HAD + B – rituximab, cytarabín, dexametazón, bortezomib; ORR – celkový počet odpovedí; CR – kompletná remisia; PFS – prežitie bez progresie; TTF – čas do zlyhania liečby; DR – trvanie odpovede; OS – celkové prežitie
Zdroj: ref 2.
Poznámky k jednotlivým režimom liečby
Režim BR (rituximab, bendamustín) je dobre účinný na liečbu MCL a môže byť použitý aj v prípade relapsu. Je možné skúsiť aj retreatment pri dlhodobej remisii po predchádzajúcom podaní, ale nie sú známe detailnejšie dáta o efektivite v prípade liečby MCL.
Kombinácia purínového analógu fludarabínu s cyklofosfamidom (FC) bola účinná pri relabovanom MCL a po režime R-FCM (rituximab, fludarabín, cyklofosfamid, miroxantrón) je celkových odpovedí 58 - 79 %. Použitie R-FCM nie je vhodné pre vekovo starších pacientov, ktorí boli už v minulosti liečení pomocou CHOP pre kumulatívnu antracyklínovú kardiálnu toxicitu (doxorubicín, mitoxantrón). U relabovaných udržiavacia monoterapia RTX signifikantne nezlepšuje trvanie odpovedí, ale zvyšuje počet pacientov s remisiami po 2 rokoch. Hlavným vedľajším účinkom režimov obsahujúcich fludarabín je hematologická toxicita. Pre vyššiu toxicitu bol v 1. línii R-FC (rituximab, fludarabín, cyklofosfamid) horší v porovnaní s kombináciou R-CHOP.
U mladých pacientov zlepšenie výsledkov liečby nastáva po použití chemoimunoterapie R-DHAP (rituximab, dexametazón, cytarabín, cisplatina), a tiež po vysokých dávkach cytarabínu v monoterapii. Na základe týchto poznatkov sa zdá byť užitočné použiť podobný modifikovaný režim s prijateľnou toxicitou pre staršiu vekovú skupinu. Pôvodný režim R-DHAP sa považuje za príliš toxický pre väčšinu starších pacientov a hľadajú sa bezpečnejšie kombinácie, ktoré obsahujú cytarabín, cisplatinu alebo iné platinové deriváty. Väčšina starších pacientov v 1. línii nedostáva vysoko-dávkovaný cytarabin (Ara-C). Ukazuje sa, že aj redukované dávky Ara-C sú tiež účinné, čo je možné zvážiť pri výbere liečby v čase relapsu. Štúdia fázy II potvrdila možnosť použitia kombinácie R-BAC (rituximab, bendamustín, cytarabín) aj u predliečných pacientov. Režim je efektívny, ale treba rátať s vyšším počtom myelosupresie.
Z nových cielených molekúl (targeted therapy) zasahujúcich do signálnych dráh malígnych buniek a tým spôsobujúcich ich apoptózu sa pri MCL uplatňujú viaceré, s rôznymi cieľmi blokády na viacerých úrovniach regulačnej kaskády metabolizmu a proliferácie buniek.
Proteazómový inhibítor bortezomib inhibuje aktiváciu nukleárneho faktora kappa B (NF-κB), a tým narúša proliferačnú cestu pri MCL. Monoterapia bortezomibom prináša 20 – 40 % celkových odpovedí, pri mediáne PFS len 6 mesiacov. Jeho hlavným nežiadúcim účinkom je neuropatia, a to senzorická, alebo prejavujúca sa ako neuropatická bolesť. Riziko neuropatie je o niečo menšie pri subkutánnom podaní oproti intravenóznemu. Je možná aj kombinácia bortezomibu s Ara-C s úpravou dávky pre starších pacientov. Ďalšou možnosťou efektívnej kombinácie bortezomibu je s režimom BR (bendamustín, rituximab).
Proliferáciu MCL blokuje aj kinázový inhibítor mTOR (mammalian target of rapamycin) temsirolimus účinný pri relabovanom MCL. Proteinkináza mTOR patrí do skupiny kináz podobných fosfatidylinositol-3-kináze (PI3K) a reguluje niekoľko bunkových procesov vrátane bunkového cyklu, bunkového metabolizmu a bunkovej proliferácie. Temsirolimus inhibíciou molekulárnej signálnej dráhy PI3K/AKT/mTOR zastavuje proliferáciu buniek MCL. Počet celkových odpovedí na monoterapiu temsirolimusom pri R/R MCL bol 40 %, z toho len 3 % kompletných, s mediánom trvania odpovede len 6 mesiacov. Pre pomerne nízku efektivitu a vyššiu toxicitu sa v klinickej praxi významne neujal.
Imunomodulačná látka lenalidomid zo skupiny IMiDs (immunomodulatory imid drugs) je účinná v liečbe viacerých B-bunkových lymfoproliferatívnych malignít a mnohopočetného myelómu. Pri liečbe relabovaného MCL dosahuje 42 – 55 % celkových odpovedí s mediánom PFS iba 6 mesiacov. V talianskej štúdii zlepšil lenalidomid medián PFS na 8,7 mesiaca, aj počet ORR v porovnaní s konvenčnou chemoterapiou v monoterapii. Dosiaľ nie je veľa randomizovaných štúdií s lenalidomidom pri MCL v monoterapii alebo kombinácii s inými liekmi. V prípade mutovaného TP53 v štúdii fázy II kombinácia lenalidomid, ibrutinib a rituximab priniesla 50 – 64 % kompletných remisií. Uvažovalo sa aj koncepte udržiavacej liečby lenalidomidom pre starších pacientov.
Veľmi dobrú účinnosť a toleranciu pri liečbe R/R MCL priniesli inhibítory BTK (inhibítory Brutónovej tyrozínkinázy). Signálna dráha B-bunkového receptora je aktivovaná pri mnohých B-bunkových malignitách a Brutónová kináza je v tejto dráhe nevyhnutná. V štúdii fázy II sa ibrutinib použil u 111 pacientov s R/R MCL s celkovým počtom 68 % OR, vrátane 21 % CR, mediánom PFS 13,9 mesiacov a nedosiahnutým mediánom OS. Ešte lepšie výsledky sa dosiahli v kombinácii ibrutinibu s režimom BR u predtým neliečených a R/R pacientov. V ďalšej štúdii fázy II sa ibrutinib kombinoval s rituximabom u R/R starších pacientov (medián veku 67 rokov), ktorí už boli predliečení predchádzajúcimi líniami liečby, pri mediáne sledovania 47 mesiacov CR dosiahlo 29 pacientov (58 %) a 12 ich ešte bolo na liečbe. Medián PFS bol 43 mesiacov a medián OS sa nedosiahol. Kratšie prežívanie sa pozorovalo u pacientov s blastoidnou morfológiou, vysokorizikovým MIPI a vysokým Ki-67. Okrem toho sa významná účinnosť pri diagnóze MCL preukázala pri kombinácii ibrutinib s antagonistom BCL-2 venetoklaxom.
Pri R/R MCL inhibítory BTK 2. generácie akalabrutinib a zanubrutinib potvrdili svoju vyššiu selektivitu v blokáde regulačnej kaskády proliferácie malígnych buniek a tým aj menšiu toxicitu oproti ibrutinibu. Ibrutinib a ďalšie inhibítory BTK sa stali štandardnou liečbou pri relapse a refraktérnom MCL. Dáta potvrdzujú, že tieto lieky sú nielen účinné, ale aj dobre tolerované a vhodné aj ako počiatočná liečba u starších pacientov nevhodných na intenzívnu chemoterapiu a ASCT. V poslednom období bolo vyvinutých niekoľko ďalších ireverzibilných a reverzibilných (nekovalentných) inhibítorov BTK, napríklad pirtobrutinib. Niektoré ďalšie nové molekuly, ktoré dokážu blokovať zložky signálnej transdukcie dráhy B-bunkového receptora, mali naopak vo včasných klinických skúškach neuspokojivé výsledky, príkladom je fostamatinib, inhibítor SYK alebo enzastaurín, inhibítor proteínkinázy C beta (PKC-β). Naopak, viaceré nové molekuly a postupy sa dostávajú do klinickej praxe s potenciálom významného vplyvu pri MCL. Príkladom je orálny bcl-2 inhibítor venetoklax v monoterapii a kombinácii s ibrutinibom s dosahovaním pomerne dlhých liečebných odpovedí aj u starších pacientov. Ďalšie kombinácie s venetoklaxom možno očakávať aj v 1. línii u nepredliečených pacientov.
Adoptívny imunoterapeutický prístup pomocou CAR-T buniek priniesol povzbudivé výsledky u R/R B-NHL vrátane pacientov s MCL. Po schválení regulačnými autoritami sa liečba CAR-T bunkami uplatňuje v klinickej praxi. V štúdii ZUMA-2 (NCT02601313) 168 pacientov s R/R MCL po 5 líniách terapie vrátane ibrutinibu dostávalo CAR-T (brexukabtagén autoleucel) s dosiahnutím 85 % ORR, 59 % CR. Pozícia CAR-T buniek v algoritme liečby MCL pri brexukabtagéne autoleuceli sa zatiaľ ukázala v indikáciách po zlyhaní kombinovanej systémovej liečby a zlyhaní terapie BTKi (ibrutinib, akalabrutinib). Na Slovensku je schválená pre dospelých pacientov s recidivujúcim alebo refraktérnym MCL, po dvoch alebo viacerých líniách systémovej liečby vrátane inhibítora Brutonovej tyrozínkinázy (BTKi).
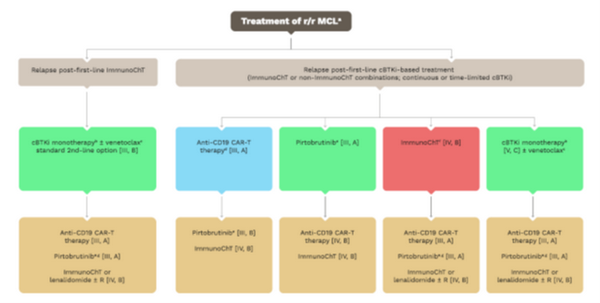
Aktuálne odporúčania Európskej hematologickej spoločnosti (EHA) pre liečbu pacientov s relabujúcim /refraktérnym MCL prináša obrázok. Tieto odporúčania už odrážajú sekvencie liečby individualizovanej podľa liekov použitých v predchádzajúcich líniách.
Zdroj: ref 3
Liečba pacientov s MCL sa s príchodom inovatívnych prípravkov dostáva do pozitívne búrlivého obdobia, na základe výsledkov medicíny založenej na dôkazoch sa menia postupy a odporúčania v prospech dlhšieho a kvalitnejšieho prežívania pacientov.
Literatúra
- WEIGLEIN, T., DREYLING, M. 2020. Mantle cell lymphoma: a spectrum of disease. ESMO Educational 2020. https://oncologypro.esmo.org/content/download /138965/2553644/1/E-Learning-Mantle-Cell-Lymphoma.pdf
- DOORDUIJN, J.K., KLUIN-NELEMANS, H.C., 2013. Management of mantle cell lymphoma in the elderly patient. In Clinical Interventions in Aging, ISSN:1178-1998, 2013, č. 8, s. 1229-1236. doi: 10.2147/CIA.S35082
- JERKEMAN M. et al. HemaSphere. 2025;9:e70233., https://doi.org/10.1002/hem3.70233
Dátum prípravy: november 2025
Kód: 000806781/2025/11