Správy zo spoločnosti Zentiva

8. decembra 2025 / Články
Systémová liečba hepatocelulárneho karcinómu (HCC)
MUDr. Blanka Puškárová, Ambulancia klinickej onkológie, Levice
Slovensko patrí ku krajinám s nízkou až strednou incidenciou HCC (cca 3-30/100 tis). Na Slovensku „metabolická“ a „alkoholová“ pečeň preberajú štafetu hlavného zdroja HCC, zatiaľ čo vírusové etiológie (aspoň HCV) postupne ustupujú.
Týmto sa mení aj profil pacienta, pretože MASLD-HCC (metabolic dysfunction-associated steatotic liver disease) často vzniká aj bez cirhózy a to nám komplikuje i pravidelné sledovanie rizikových pacientov. Pacienti sú často starší, obézni, s diabetes mellitus II typu, arteriálnou hypertenziou, dyslipidémiou a kardiovaskulárnou komorbiditou. Alkoholická choroba pečene tvorí 50 % HCC na Slovensku.
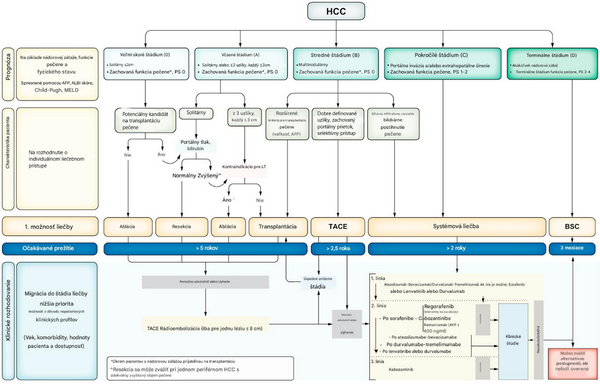
Možnosti liečby HCC sú veľmi komplexné, algoritmus liečby vychádza z tzv. Barcelonskej klasifikácie. BCLC systém stratifikuje pacientov podľa niekoľko faktorov a pacientov zaradí do štádia 0, A, B, C a D.
Systémová liečba je indikovaná u pacientov s pokročilým (BCLC C) alebo intermediárnym štádiom ochorenia (BCLC B), ktorí nie sú vhodní na lokoregionálnu liečbu alebo na nej zlyhali.
Nové odporučenia ESMO 2025 ohľadom systémovej onkologickej liečby reflektujú v 1.línii liečby posun smerom k preferencii imunoterapie, pokiaľ nie je kontraindikovaná. Napriek tomu, že imunoterapia dokazuje vyššiu účinnosť je treba zohľadniť i vhodnosť pre konkrétneho pacienta a zdá sa, že aj etiológia môže byť významným faktorom účinnosti jednotlivých typov systémovej liečby.
Pred výberom systémovej onkologickej liečby musíme posúdiť:
- celkový a výkonnostný stav pacienta
- prítomnosť komorbidít (hlavne tie, ktoré by mohli byť KI k imunoterapii a anti-VEGF liečbe)
- etiológiu základného ochorenia
- rozsah ochorenia
- funkčný stav pečene (Child Pugh skóre)
- očakávaný prínos liečby
1. línia systémovej liečby:
Štandard:
Kombinácia imunoterapie (IO):
atezolizumab + bevacizumab (dostupný na SK)
durvalumab + tremelimumab (nedostupný na SK)
Pacient vhodný na IO:
- na Slovensku je aktuálne podmienkou schválenia úhrady liečby pokročilý alebo neresekovateľný HCC u pacientov s pečeňovou funkciou Child Pugh A
- motivovaný pacient v dobrom celkovom stave, nutná spolupráca s predpokladom včasného záchytu prípadnej toxicity.
Pacient s kontraindikáciou alebo nevhodný na IO:
Inhibítory TK:
Pacient vhodný na sorafenib:
| Podľa charakteristiky pacientov v registračnej klinickej štúdii REFLECT (lenvatinib vs sorafenib) |
Podľa celkového stavu pacienta |
Podľa komorbidity pacienta |
|
|
|
Nevýhody sorafenibu:
- nižšia ORR a kratší PFS vs lenvatinib (OS non-inferior, ale kontrola choroby je spravidla lepšia pri lenvatinibe)
- toxicita liečby v zmysle hand-foot a hnačiek
Pacient vhodný na lenvatinib:
| Podľa charakteristiky pacientov v registračnej klinickej štúdii REFLECT (lenvatinib vs sorafenib) |
Podľa celkového stavu pacienta | Podľa komorbidity pacienta |
|
|
|
Nevýhody lenvatinibu:
- riziko zhoršenia arteriálnej hypertenzie, renálnej dysfunkcie , proteinúrie, edémov
- v registračnej štúdii REFLECT boli z liečby lenvatinib vylúčení pacienti s viac ako 50 % postihnutím pečene s HCC, makroskopickou inváziou do žlčových ciest a nádory s inváziou do kmeňa vena portae
- titrácia dávky je menej jemná, hlavne pre kachektických pacientov.
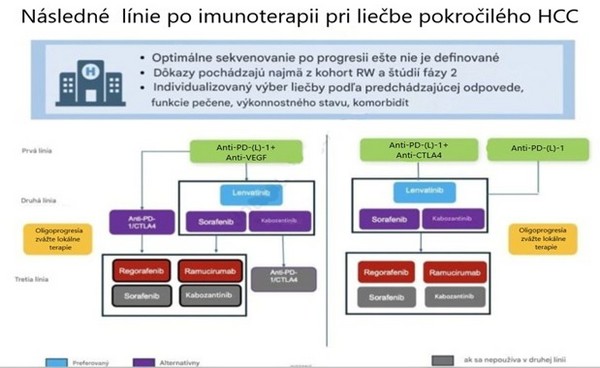
2. línia systémovej liečby:
Pred indikáciou 2.línie liečby treba vždy zvažovať, či má pokračovanie v liečbe zmysel. Ak pacient chce pokračovať v liečbe, nemal rýchlu a výraznú progresiu ochorenia a výrazné zhoršenie zdravotného stavu a je v dobrom výkonnostnom stave ECOG 0-1 vyberáme liečbu do 2. línie hlavne podľa toho, akú liečbu mal v 1. línii.
Na Slovensku sú možné 2 scenáre:
A: 1.línia atezolizumab + bevacizumab – možnosti 2.línie:
- lenvatinib – ak je nádorová nálož menej ako 50 % pečene, nie je prítomná invázia hlavného kmeňa vena portae, cieľom je vyššia ORR a KV alebo renálne riziko je akceptovateľné
- sorafenib – pri masívnej nádorovej náplni alebo invázii HCC do hlavného kmeňa portálnej vény, výrazná biliárna invázia, pri výraznom KV/ renálnom riziku a pri potrebe jemnej titrácii dávky.
B: 1.línia sorafenib alebo lenvatinib – možnosti 2.línie:
- po sorafenibe 2. línia: regorafenib - ak sorafenib bol tolerovaný, ale došlo k progresii ochorenia
- po lenvatinibe 2.línia: regorafenib
- ramucirumab ani kabozantinib nemáme na Slovensku dostupný, kategorizovaný
3.línia systémovej liečby:
O tretej línii liečby by sme mohli uvažovať len u fit pacientov. Očakávaný benefit liečby je však už malý a preto veľmi treba zvažovať či je reálny nejaký klinický prínos alebo bude lepšie pacientovi ponúknuť kvalitnú paliatívnu starostlivosť zameranú na symptómy a zachovanie čo najlepšej kvality života.
Systémová liečba HCC reálne zlepšila prežívanie pacientov s pokročilým ochorením. Imuno-kombinácie posunuli medián OS do rozmedzia 16-20 mesiacov u vybraných pacientov s podstatne vyššou mierou objektívnych odpovedí, vrátane niektorých dlhých odpovedí, ale stále nejde o kuratívnu liečbu.
Zoznam použitej literatúry
- Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209–249. doi:10.3322/caac.21660.
- Rumgay H, Ferlay J, de Martel C, et al. Global burden of primary liver cancer in 2020 and predictions to 2040. J Hepatol. 2022;77(6):1598–1606. doi:10.1016/j.jhep.2022.08.021.
- Yang JD, Hainaut P, Gores GJ, Amadou A, Plymoth A, Roberts LR. A global view of hepatocellular carcinoma: trends, risk, prevention and management. Nat Rev Gastroenterol Hepatol. 2019;16(10):589–604. doi:10.1038/s41575-019-0186-y.
- Huang DQ, El-Serag HB, Loomba R. Global epidemiology of NAFLD-related hepatocellular carcinoma: trends, predictions, risk factors and prevention. Nat Rev Gastroenterol Hepatol. 2021;18(4):223–238. doi:10.1038/s41575-020-00381-6.
- Forner A, Reig M, Bruix J. Hepatocellular carcinoma. Lancet. 2018;391(10127):1301–1314. doi:10.1016/S0140-6736(18)30010-2.
- Marrero JA, Kulik LM, Sirlin CB, et al. Diagnosis, staging, and management of hepatocellular carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology. 2018;68(2):723–750. doi:10.1002/hep.29913.
- Singal AG, Llovet JM, Yarchoan M, et al. AASLD Practice Guidance on prevention, diagnosis, and treatment of hepatocellular carcinoma. Hepatology. 2023;78(6):1922–1965. doi:10.1097/HEP.0000000000000466.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol. 2018;69(1):182–236. doi:10.1016/j.jhep.2018.03.019.
- Sangro B, Argemi J, Ronot M, et al. EASL Clinical Practice Guidelines on the management of hepatocellular carcinoma. J Hepatol. 2024;82(6):315–374. doi:10.1016/j.jhep.2024.08.028.
- Reig M, Forner A, Rimola J, et al. BCLC strategy for prognosis prediction and treatment recommendation: The 2022 update. J Hepatol. 2022;76(3):681–693. doi:10.1016/j.jhep.2021.11.018.
- Bruix J, Chan SL, Galle PR, et al. Systemic treatment of hepatocellular carcinoma: an EASL position paper. J Hepatol. 2021;75(4):960–974. doi:10.1016/j.jhep.2021.07.004.
- Llovet JM, Ricci S, Mazzaferro V, et al; SHARP Investigators Study Group. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359(4):378–390. doi:10.1056/NEJMoa0708857.
- Kudo M, Finn RS, Qin S, et al. Lenvatinib versus sorafenib in first-line treatment of unresectable hepatocellular carcinoma (REFLECT): a randomized, open-label, non-inferiority phase 3 trial. Lancet. 2018;391(10126):1163–1173. doi:10.1016/S0140-6736(18)30207-1.
- Bruix J, Qin S, Merle P, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib (RESORCE): a randomized, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017;389(10064):56–66. doi:10.1016/S0140-6736(16)32453-9.
- Abou-Alfa GK, Meyer T, Cheng AL, et al. Cabozantinib in patients with advanced and progressing hepatocellular carcinoma (CELESTIAL): a randomized, placebo-controlled, phase 3 trial. N Engl J Med. 2018;379(1):54–63. doi:10.1056/NEJMoa1717002.
- Zhu AX, Kang YK, Yen CJ, et al. Ramucirumab after sorafenib in patients with advanced hepatocellular carcinoma and elevated α-fetoprotein concentrations (REACH-2): a randomized, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2019;20(2):282–296. doi:10.1016/S1470-2045(18)30937-9.
- Finn RS, Qin S, Ikeda M, et al. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. N Engl J Med. 2020;382(20):1894–1905. doi:10.1056/NEJMoa1915745.
- Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. N Engl J Med. 2022;386(10):999–1011. doi:10.1056/NEJMoa2108749.
Dátum prípravy: november 2025
Kód materiálu: 000806885/2025/11