Správy zo spoločnosti Zentiva
29. septembra 2025 / Články
Liečba pacientov s mnohopočetným myelómom v druhej línii na Slovensku a vo svete
Liečba pacientov s mnohopočetným myelómom v druhej línii na Slovensku a vo svete
Juliana Holasová1,2
- Hematologické oddelenie, Fakultná nemocnica F. D. Rooosevelta, Banská Bystrica,
- Lekárska fakulta, Slovenská zdravotnícka univerzita, Bratislava
Mnohopočetný myelóm patrí k diagnózam, kde sa terapeutické postupy v posledných rokoch výrazne zmenili. Cieľ zostáva avšak ten istý, dosiahnuť čo najlepší efekt liečby a dlhé prežívanie pacientov. Dôraz sa kladie na hĺbku dosiahnutej remisie ochorenia, pričom dosiahnutie negativity minimálnej reziduálnej choroby (MRD) predikuje pacienta k dlhšiemu prežívaniu bez progresie ochorenia aj k celkovému prežívaniu.
1. Úvod
Mnohopočetný myelóm (MM) je B-bunková malignita, charakterizovaná proliferáciou klonálnych plazmatických buniek v kostnej dreni a v extramedulárnych lokalitách, ktorý predstavuje 1-2% zo všetkých nádorových ochorení a 10-15% všetkých hematologických malígnit (1). V Európe je MM druhým najčastejším hematologickým ochorením s odhadovanou incidenciou 4,5-6,0 prípadov na 100 000 obyvateľov ročne (1,2). Prvolíniová liečba ochorenia pozostáva z indukčnej liečby s následnou autológnou transplantáciou periférnych kmeňových buniek (ASCT) u vhodných pacientov (cca do 70 roku života, bez závažných komorbidít) a udržiavacou liečbou lenalidomidom. Za posledných 20 rokov sa výsledky prežívania pacientov s MM podstatne zlepšili. Spomedzi tých, ktorí sa zúčastnili klinických štúdií, takmer 60% pacientov, ktorí podstúpili ASCT zostalo nažive 10 rokoch po ASCT (3). Údaje z programu dohľadu, epidemiológie a konečných výsledkov (SEER) naznačujú, že 5-ročné celkové prežívanie (OS) u všetkých pacientov s MM bolo v roku 2024 61,1%, a z toho iba 10-15% pacientov dosiahne očakávané prežívanie zodpovedajúce všeobecnej populácii (4,5).
Väčšina pacientov relabuje po prvej línii liečby s potrebou záchrannej liečby (6). Možnosti liečby v prvej línii v Slovenskej republike sa priblížili k západnej Európe a USA, avšak v druhej línii sú možnosti liečby u nás výrazne redukované.
Otázkou zostáva ako manažovať pacientov na udržiavacej liečbe lenalidomidom a daratumumabom. Udržiavacia liečba lenalidomidom je indikovaná u pacientov po autológnej transplantácii periférnymi kmeňovými bunkami (ASCT), udržiavacia liečba daratumumabom a lenalidomidom je indikovaná u pacientov, ktorí nepodstúpili ASCT a dostávali v prvej línii liečby režim DRd (daratumumab, lenalidomid, dexametazón). V SR máme možnosť sledovať hĺbku odpovede vyšetrením minimálnej reziduálnej choroby (MRD) pomocou flowcytometrického vyšetrenia (FC), ďalšou metodikou k hodnoteniu MRD je next generation sequencing (NGS), ktorá zatiaľ v SR nie je dostupná. Na základe výsledku FC vyšetrenia môžeme liečbu ukončiť, v prípade pozitívneho nálezu t.j. pretrvávania aktivity ochorenia v liečbe pokračovať. Ak však pacient progreduje na udržiavacej liečbe, sú naše možnosti následnej liečby výrazne obmedzené v porovnaní s okolitými krajinami. V SR nie je druholíniová inovatívna a cielená liečba mnohopočetného myelómu kategorizovaná.
Cieľom liečby pacientov s MM je dosiahnutie negatívnej MRD, čo je silným prediktorom priaznivej prognózy a koreluje so zlepšeným PFS a OS u pacientov s NDMM aj u pacientov s relabujúcim/refrakterným mnohopočetným myelómom (RRMM). Dosiahnutie MRD negativity je potrebné potvrdiť vyšetrením kostnej drene (FC vyšetrením alebo NGS vyšetrením), a takisto aj mimo kostnej drene PET/CT vyšetrením. V súčasnosti je MRD hodnotenie považované za koncový výsledok klinických registračných štúdií (7,8,9), v bežnej rutinnej klinickej praxi sa zatiaľ nepoužíva.
Medzinárodná myelómová pracovná skupina (IMWG) definuje RRMM ako progresívne ochorenia, neadekvátne odpovedajúce na liečbu, s progresiou ochorenia do 60 dní od ukončenia liečby s dosiahnutím remisie ochorenia, prípadne u pacientov ktorí nedosiahli ani minimálnu remisiu ochorenia sa jedná o primárne refraktérne ochorenie. Títo pacienti vyžadujú liečbu kombináciou nových liekov, pričom platí že hĺbka dosiahnutej odpovede a dĺžka trvania odpovede je s každou ďalšou líniou kratšia (10).
2. Liečba RRMM v SR
Stratégia liečby by mala byť individualizovaná a optimalizovaná na základe stavu pacienta, veku, pridružených ochorení, ale aj predchádzajúcej prvolíniovej liečby pacienta. Všeobecne platí, že v druhej línii liečby by nemali byť použité tie isté lieky ako v predchádzajúcej línii. K režimom, ktoré vieme použiť u pacientov v SR v druhej línii patrí: IRD (ixazomib+ lenalidomid+ dexametazón), KRD (karfilzomib+ lenalidomid+ dexametazón), RD (lenalidomid+ dexametazón), aj to nie u všetkých pacientov. Oba najúčinnejšie režimy v druhej línii sú obmedzené na určitú skupinu pacientov. Režim IRD podľa indikačných obmedzení je hradený v druhej línii (11) u pacientov s vysokorizikovou cytogenetikou, definovanou prítomnosťou niektorej z cytogenetických aberácií del(17p), t(4;14), t(14;16), režim KRD je v 2. línii liečby indikovaný u pacientov s mnohopočetným myelómom, ktorí už podstúpili a nie sú vhodní na: opakovanú transplantáciu vlastných kmeňových buniek (ASCT), nie sú vhodní na liečbu bortezomibom, preukázali progresiu ochorenia a majú štandardné cytogenetické riziko, definované neprítomnosťou niektorej z cytogenetických aberácií del(17p), t(4;14), t(14;16).
Okrem uvedených režimov je možné pacientov liečiť klasickými chemoterapeutickými režimami, kam patrí napr. režim VAD (bortezomib+ doxorubucín+ dexametazón), BBD (bendamustín+ bortezomib+ dexametazón), CED (cyklofosfamid+ etopozid+ dexametazón), PACE( cisplatina, etopozid, doxorubicín, cyklofosfamid), ktoré ale nepatria k odporúčaným liečebným režimom podľa medzinárodných odporúčaní pacientov s MM (7).
Liečba relapsu MM je zvyčajne založená na odpovedi pacienta na lenalidomid. Ak dôjde k progresii ochorenia u pacienta do 60 dní od štandardnej liečby lenalidomidom, považuje sa ochorenie refraktérne na lenalidomid. V opačnom prípade sa pacienti považujú za citlivých na lenalidomid, ak sa relaps alebo progresia zaznamená po viac ako 60 dňoch liečby lenalidomidom (12).
V západných krajinách je situácia iná, možností majú viacero, vrátane použitia najmodernejšej liečby bišpecifickými protilátkami a CART bunkami a aktuálne schvaľovaným belantamab mafodotínom.
3. Liečba RRMM podľa medzinárodných odporučaní
Aktuálne boli publikované nové EHA - EMN ( European Hematology Association- European Myeloma Network) odporúčania pre diagnostiku, liečbu a sledovanie pacientov s mnohopočetným myelómom (7). Liečebné režimy druhej línie sa vyberajú na základe účinnosti, toxicity a refraktérnosti na predtým podávané režimy ako aj na základe komorbidít pacientov. Pacienti, ktorí nedostávali lenalidomid alebo majú ochorenie citlivé na tento liek, by mali dostávať režimy, podľa odporúčaní v usmerneniach EHA z roku 2021, alebo nové režimy podľa aktuálnych odporúčaní. S uvedenými novými liekmi a režimami súvisí aj výskyt nových nežiaducich účinkov, ktoré vyžadujú adekvátny manažment.
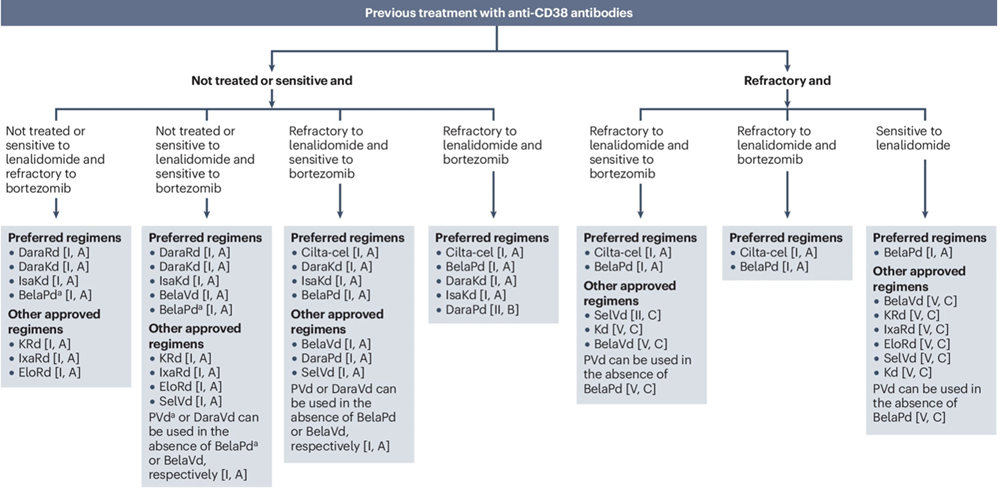
EHA - EMN odporúčania pre liečbu pacientov s RRMM v druhej línii po predchádzajúcej liečbe s daratumumabom
Bela, belantamab mafodotín; cilta-cel, ciltacabtagene autoleucel; d, dexametazón; Dara, daratumumab; Elo, elotuzumab; Isa, isatuximab; Ixa, ixazomib; K, karfilzomib; P, pomalidomid; R, lenalidomid; Sel, selinexor.
Belantamab mafodotín (v kombináciách skrátene „Bela“) je konjugát protilátky a liečiva (ADC), Tento ADC bol odporúčaný na schválenie Výborom pre lieky na humánne použitie (CMHP) EMA (Európska lieková agentúra ) v kombinácii s Vd alebo pomalidomidom (v kombináciách skrátene „P“) plus dexametazónom na liečbu pacientov s RRMM, ktorí predtým dostali jednu až tri línie liečby; v čase publikácie tohto článku sa očakáva schválenie FDA. V štúdii fázy III DREAMM-794,95 bolo 494 pacientov náhodne pridelených (1:1) na liečbu BelaVd oproti DaraVd. Pri mediáne sledovania 39,4 mesiaca bol medián PFS 36,6 mesiaca s BelaVd oproti 13,4 mesiaca s DaraVd (HR 0,41, 95% CI 0,31–0,53; P < 0,001). OS po 36 mesiacoch bolo lepšie s BelaVd (74 % oproti 60 %; HR 0,58, 95% CI 0,43–0,79; P < 0,001). Očná toxicita bola častejšia s BelaVd (79 % oproti 29 % s DaraVd); tieto nežiaduce účinky boli zvládnuté úpravou dávky a väčšina (87 %) ustúpila. Je potrebné poznamenať, že 33 % a 0 % pacientov v skupine s BelaVd malo ochorenie refraktérne na lenalidomid a na daratumumab, v uvedenom poradí (13,14).
Na základe liečby prvej línie sa očakáva, že mnohí pacienti budú refraktérni na lenalidomid. Dve štúdie s výsledkami publikovanými po poslednej (2021) aktualizácii smerníc EHA sa zamerali na túto populáciu pacientov. V štúdii fázy III CARTITUDE-4 bolo 419 pacientov s MM refraktérnych na lenalidomid, ktorí predtým dostali jednu až tri línie liečby, náhodne pridelených (1:1) na liečbu produktom chimerického antigénového receptora (CAR) T buniek ciltacabtagene autoleucel (cilta-cel) oproti SOC (PVd alebo DaraPd). Pri mediáne sledovania 33,6 mesiaca sa medián PFS nedosiahol s cilta-celom oproti 11,8 mesiacom so štandardnou liečbou (HR 0,29, 95% CI 0,22–0,39; P < 0,001). Po 30 mesiacoch bolo PFS 59,4% oproti 25,7% a OS bolo tiež lepšie s cilta-celom: 76,4 % oproti 63,8 % (HR 0,55, 95% CI 0,39–0,79; P < 0,001). Väčšie percento pacientov v skupine s cilta-celom malo MRD-negatívne ochorenie: 62 % oproti 18,5 %. U pacientov podstupujúcich liečbu ciltacelom (176 pacientov) bol zaznamenaný vyšší výskyt nežiaducich účinkov, syndróm uvoľňovania cytokínov (CRS) u 76% pacientov, z toho 3. – 4. stupňa u 1 %; 5 % pacientov malo syndróm neurotoxicity asociovanej s imunitnými efektorovými bunkami (ICANS), 1. – 2. stupňa; 13 % pacientov malo neurologické nežiaduce účinky nespôsobené ICANS, a 3. stupeň bol zaznamenaný u < 2 % pacientov. Jednou z výhrad k tejto štúdii je, že do porovnávacej skupiny neboli zahrnuté režimy ako DaraKd alebo IsaKd, ktoré preukázali najlepšie výsledky u pacientov s ochorením refraktérnym na lenalidomid.
Na základe vyššie uvedených údajov bol cilta-cel schválený agentúrou EMA na liečbu pacientov s RRMM refraktérnym na lenalidomid, ktorí dostali aspoň jednu predchádzajúcu líniu liečby, vrátane imunomodulačného lieku a inhibítora proteazómu a majú progresiu ochorenia po poslednej línii liečby (15,16).
V druhej štúdii fázy III DREAMM-8, bolo 302 pacientov s RRMM, ktorí dostali aspoň jednu líniu liečby s lenalidomidom náhodne rozdelených (1:1) do skupín s BelaPd oproti PVd. Pri mediáne sledovania 21,8 mesiaca bolo odhadované 12-mesačné PFS 71 % oproti 51 % (HR 0,52, 95 % CI 0,37 – 0,73; P < 0,001). U pacientov s ochorením refraktérnym na lenalidomid (78 % kohorty) bol medián PFS 25 mesiacov s BelaPd oproti 8,6 mesiaca s PVd (HR 0,31, 95 % CI 0,19 – 0,48). Očné nežiaduce účinky sa vyskytli u 89 % pacientov, ktorí dostávali BelaPd (stupeň 3 – 4 u 43 %) a u 30 % pacientov, ktorí dostávali PVd (stupeň 3 – 4 u 2 %). Medián intenzity dávky belantamab mafodotínu bol 1,9 mg/kg podávaný každých 8 – 12 týždňov, napriek plánovanej dávke 2,5 mg/kg každé 4 týždne počas prvého cyklu a 1,9 mg/kg každé 4 týždne od druhého cyklu a ďalej. Očné nežiaduce účinky viedli k ukončeniu liečby u 9 % pacientov v skupine s BelaPd. Schválenie režimu BelaPd regulačnými orgánmi je v procese čakania (17,18).
Ďalším novým režimom v odporúčaniach je kombinácia selinexoru (v kombináciách skrátene „Sel“) s Vd, ktorá bola schválená agentúrami EMA a FDA v júni 2022 na liečbu pacientov s RRMM, ktorí predtým dostali jednu až tri línie liečby na základe výsledkov fázy III štúdie BOSTON, ktorá porovnávala režim SelVd s Vd. Výsledky s mediánom doby sledovania 28 mesiacov boli publikované v roku 2024. Medián PFS bol dlhší v režime s pridaním selinexoru vo všetkých podskupinách pacientov (P < 0,05). Pacienti s ochorením refraktérnym na lenalidomid mali dlhšie OS so SelVd (26,7 mesiaca oproti 18,6 mesiacom s Vd (HR 0,53, 95 % CI 0,30–0,95; P = 0,015). Najčastejšími nežiaducimi účinkami 3. – 4. stupňa v tejto štúdii boli trombocytopénia (39 % oproti 17 %), únava (13 % oproti 1 %), anémia (16 % oproti 10 %) a pneumónia (11 % oproti 11 %). Medzi ďalšie nežiaduce účinky súvisiace so SelVd patrili gastrointestinálne ťažkosti, ako je nevoľnosť, vracanie alebo hnačka, ktoré si vyžadovali úpravu dávky selinexoru a profylaxiu s najmenej dvoma antiemetikami (19-21).
Liečba pacientov s MM refraktérnym na lenalidomid aj daratumumab je veľmi náročná. Štúdia CARTITUDE-4 (15,16) a DREAMM-8 (17,18) sú jediné štúdie fázy III, ktoré zahŕňali takýchto pacientov, ale percento týchto pacientov bolo v oboch štúdiách nízke (<25 %). Na základe údajov, ktoré sú v súčasnosti dostupné z klinických štúdií, sú cilta-cel a BelaPd preferovanou možnosťou u týchto pacientov a režim KPd by mohol byť alternatívnou možnosťou. V štúdii fázy II SELECT (22) dostalo 52 pacientov KPd pri prvom alebo druhom relapse, z ktorých 75 % malo ochorenie refraktérne na lenalidomid aj daratumumab. Karfilzomib sa podával raz týždenne v dávke 56 mg/m2. Medián PFS bol 11,1 mesiaca a medián OS bol 18,8 mesiaca. V ďalšej štúdii fázy II (23) dostávalo 111 pacientov s progresiou ochorenia alebo relapsom v predchádzajúcej štúdii fázy III EMN02 u pacientov s NDMM (24) vhodných na transplantáciu druhú líniu liečby s KPd. Spomedzi týchto pacientov, 77 % dostávalo bortezomib a lenalidomid, ale žiadny nedostával daratumumab. Po ukončení ôsmich cyklov KPd boli pacienti náhodne rozdelení na kontinuálnu liečbu buď samotným pomalidomidom (n = 44) alebo Pd (n = 42). Pri mediáne sledovania 40 mesiacov bol medián PFS 26 mesiacov. KPd je široko dostupný režim, ale kvôli nedostatku registračných štúdií nie je schválený EMA ani FDA (Úrad pre kontrolu potravín a liečiv) na liečbu pacientov s RRMM.
Všeobecné odporúčania pre jednotlivé skupiny pacientov (7):
- U pacientov, ktorí dostávali režim založený na bortezomibe bez lenalidomidu alebo protilátke proti CD38 a majú ochorenie refraktérne na bortezomib preferovanými režimami pre týchto pacientov sú DaraRd, DaraKd a IsaKd [I, A]. Medzi ďalšie odporučené režimy patria KRd, IxaRd a elotuzumab (v kombináciách skrátene „Elo“) plus Rd [I, A]. U pacientov, ktorí dostávali lenalidomid, sa môže použiť aj BelaPd [I, A].
- Pacienti, ktorí dostávali režim založený na bortezomibe bez lenalidomidu alebo protilátky proti CD38 a majú ochorenie citlivé na bortezomib, by mali prednostne dostávať DaraRd, DaraKd, IsaKd alebo BelaVd [I, A]. Ďalšie schválené režimy zahŕňajú KRd, IxaRd, EloRd, SelVd a Kd [I, A]. U pacientov, ktorí dostávali lenalidomid, je BelaPd tiež účinnou možnosťou [I, A]. DaraVd alebo PVd sa môžu použiť aj v prípade, že BelaVd alebo BelaPd nie sú k dispozícii [konsenzus panelu; I, A].
- Pacienti, ktorí sú vhodní na liečbu CAR T bunkami s ochorením refraktérnym na lenalidomid v prvej línii a ktorí nedostávali alebo majú ochorenie citlivé na protilátky anti-CD38, by mali dostávať cilta-cel, ak je k dispozícii [I, A]. Ďalšie možnosti u pacientov s ochorením refraktérnym na lenalidomid zahŕňajú DaraKd, IsaKd, BelaPd, BelaVd, DaraPd a SelVd [I, A]; kombinácie protilátok anti-CD38 s Kd alebo BelaPd poskytujú najlepšie výsledky u pacientov s MM refraktérnym na lenalidomid a sú uprednostňované. PVd alebo DaraVd sa môžu použiť, ak BelaPd alebo BelaVd nie sú k dispozícii [konsenzus panelu; I, A].
- Pacienti s ochorením refraktérnym na lenalidomid aj bortezomib, a ktorí nedostali alebo majú ochorenie citlivé na protilátky proti CD38, by mali dostať cilta-cel, BelaPd, DaraKd alebo IsaKd [I, A] alebo DaraPd [II, B]. U pacientov s ochorením refraktérnym na lenalidomid aj daratumumab sú preferovanými možnosťami cilta-cel a BelaPd [I, A] pretože sú to jediné režimy, ktoré boli skúšané u pacientov, ktorí predtým dostávali lenalidomid aj daratumumab, v počiatočnom štádiu relapsu. SelVd [II, C], BelaVd [V, C] a Kd [V, C] sa v tomto nastavení môžu použiť (iba u pacientov s ochorením citlivým na bortezomib), ak nie sú k dispozícii iné možnosti; toto odporúčanie však podporujú obmedzené dôkazy, pretože takmer žiadni pacienti s ochorením refraktérnym na daratumumab neboli zaradení do registračných štúdií týchto režimov [konsenzus panelu].
- U pacientov s obmedzeným prístupom k novým liečebným režimom môže byť druholíniová záchranná liečba pomocou ASCT vhodnou možnosťou pre tých, ktorí absolvovali primárnu liečbu vrátane ASCT, po ktorej nasledovala udržiavacia liečba lenalidomidom, a dosiahli počiatočnú remisiu trvajúcu ≥36 mesiacov [konsenzus panelu; III, C].
Podporná liečba
Dôležitou súčasťou liečby pacientov s MM je podporná liečba, ktorá zahŕňa liečbu kostnej choroby, anémie a ostatných cytopénií, infekcií a renálneho zlyhania. Do popredia sa dostávajú komplikácie (nežiaduce účinky) najnovších liekov- očnej toxicity pri liečbe belantamabom, sydróm cytokínovej búrky tzv. CRS (cytokine- release) syndróm a ICANS (Immune effector cell-associated neurotoxicity syndrome) pri liečbe bišpecifickými protilátkami a CAR-T bunkami. V nových EHA-EMN odporúčaniach sú obsiahnuté aj odporúčania ako pri uvedených nových komplikáciách liečby pacientov s MM postupovať (7).
Záver
Nové EHA-EMN usmernenia, vychádzajúce z analýzy nových dát a schválení EMA a FDA medzi rokmi 2021 – 2025, prinášajú praktické odporúčania pre liečbu mnohopočetného myelómu v rôznych klinických situáciách. V tomto období agentúry schválili 14 nových liekov, alebo kombinácií, čo sa nedá porovnať s možnosťami liečby pacientov v SR, kde väčšinu z uvedených režimov nemáme k dispozícii. Zdôraznená je potreba nových kritérií odpovede, ktoré lepšie vystihnú účinnosť moderných terapií a umožnia presnejšie terapeutické rozhodnutia.
Dostupnosť inovatívnych liekov a CAR T produktov zostáva nerovnomerná medzi regiónmi (v SR aktuálne CAR T liečba pre pacientov s mnohopočetným myelómom nie je dostupná), smernice ponúkajú cenný rámec pre klinickú prax nielen v Európe, ale aj mimo nej. Predstavujú dôležitý krok k budúcnosti, v ktorej pokrok v liečbe prináša pacientom reálnu nádej na dlhodobé prežívanie a – pre niektorých – aj na úplné vyliečenie.
Citácie:
1. Malard, F. et al. Multiple myeloma. Nat. Rev. Dis. Prim. 10, 45 (2024).
2. Sun, et al. Global landscape and trends in lifetime risks of haematologic malignancies in 185 countries: population-based estimates from GLOBOCAN 2022. ClinicalMedicine 83, 103193 (2025).
3. Sonneveld, P. et al. Consolidation treatment with VRD followed by maintenance with lenalidomide in multiple myeloma improves overall survival: long-term follow-up of the EMN02/HOVON95 randomized phase 3 trial. Blood 144, 674–674 (2024).
4. Surveillance, Epidemiology, and End Results Program. Cancer stat facts: myeloma. NIH https://seer.cancer.gov/statfacts/html/mulmy.html (2024).
5. Engelhardt, M., Kortum, K. M., Goldschmidt, H. & Merz, M. Functional cure and long-term survival in multiple myeloma: how to challenge the previously impossible. Haematologica 109, 2420–2435 (2024).
6. Martinez-Lopez, J. et al. Real-world treatment patterns, healthcare resource use and disease burden in patients with multiple myeloma in Europe. Future Oncol. 19, 2103–2121(2023).
7. Dimopoulos MA et al., EHA-EMN Evidence-Based Guidelines for diagnosis, treatment and follow-up of patients with multiple myeloma. Nat Rev Clin Oncol. 2025 Jul 7. doi: 10.1038/s41571-025-01041-x. Epub ahead of print. PMID: 40624367
8. Paiva, B. et al. Impact of treatment effect on MRD and PFS: an aggregate data analysis from randomized clinical trials in multiple myeloma. Blood Adv. 8, 219–223 (2024).
9. Ntanasis-Stathopoulos, I. et al. Evaluating minimal residual disease negativity as a surrogate endpoint for treatment efficacy in multiple myeloma: a meta-analysis of randomized controlled trials. Am. J. Hematol. 100, 427–438 (2025).
10. Diagnostika a léčba mnohočetného myelomu. Transfuze a hematologie dnes, 2018; 24(Suppl. 1): 7–23.
11. https://www.health.gov.sk/ cast_B_ind_obmedzenia_k_01_02_2025
12. Relapsed and Refractory Multiple Myeloma - dopísať
13. Hungria, V. et al. Belantamab mafodotin, bortezomib, and dexamethasone for multiple myeloma. N. Engl. J. Med. 391, 393–407 (2024).
14. Hungria, V. et al. Belantamab mafodotin, bortezomib, and dexamethasone vs daratumumab, bortezomib, and dexamethasone in relapsed/refractory multiple myeloma: overall survival analysis and updated efficacy outcomes of the phase 3 dreamm-7 trial [abstract]. Blood 144, 772 (2024).
15. San-Miguel, J. et al. Cilta-cel or standard care in lenalidomide-refractory multiple myeloma. N. Engl. J. Med. 389, 335–347 (2023).
16. Popat, R. et al. Ciltacabtagene autoleucel (Cilta-cel) vs standard of care (SoC) in patients with lenalidomide (Len)-refractory multiple myeloma (MM) after 1-3 lines of therapy: minimal residual disease (MRD) negativity in the phase 3 Cartitude-4 trial [abstract]. Blood 144, 1032 (2024).
17. Dimopoulos, M. A. et al. Belantamab mafodotin, pomalidomide, and dexamethasone in multiple myeloma. N. Engl. J. Med. 391, 408–421 (2024).
18. Trudel, S. et al. Results from the randomized phase 3 DREAMM-8 study of belantamab mafodotin plus pomalidomide and dexamethasone (BPd) vs pomalidomide plus bortezomib and dexamethasone (PVd) in relapsed/refractory multiple myeloma (RRMM) [abstract]. J. Clin. Oncol. 42, LBA105 (2024).
19. Grosicki, S. et al. Once-per-week selinexor, bortezomib, and dexamethasone versus twice-per-week bortezomib and dexamethasone in patients with multiple myeloma (BOSTON): a randomised, open-label, phase 3 trial. Lancet 396, 1563–1573 (2020).
20. Mateos, M. V. et al. Impact of prior treatment on selinexor, bortezomib, dexamethasone outcomes in patients with relapsed/refractory multiple myeloma: extended follow-up subgroup analysis of the BOSTON trial. Eur. J. Haematol. 113, 242–252 (2024).
21. Gavriatopoulou, M. et al. Integrated safety profile of selinexor in multiple myeloma: experience from 437 patients enrolled in clinical trials. Leukemia 34, 2430–2440 (2020).
22. Perrot, A. et al. An open-label phase 2 study treating patients with first or second relapse of multiple myeloma with carfilzomib, pomalidomide, and dexamethasone (KPd): SELECT study. Leuk. Lymphoma 65, 833–842 (2024).
23. Sonneveld, P. et al. Carfilzomib, pomalidomide, and dexamethasone as second-line therapy for lenalidomide-refractory multiple myeloma. Hemasphere 6, e786 (2022).
24. Cavo, M. et al. Autologous haematopoietic stem-cell transplantation versus bortezomib– melphalan–prednisone, with or without bortezomib–lenalidomide–dexamethasone consolidation therapy, and lenalidomide maintenance for newly diagnosed multiple myeloma (EMN02/HO95): a multicentre, randomised, open-label, phase 3 study. Lancet Hematol. 7, e456–e468 (2020).
Dátum prípravy: september 2025
Kód: 000789928/2025/09